Meditsiinivoodeid võib nimetada ka ravivooditeks, ravivooditeks, põetusvooditeks jne. Neid voodeid kasutavad patsiendid haiglaravi ajal. Neid kasutatakse peamiselt suuremates haiglates, linnade tervisekeskustes, kogukonna tervishoiuteenuste keskustes jne.
USA FDA nõuab, et kui toiduained ja meditsiinitooted sisenevad USA turule, peavad need olema registreeritud USA FDA ametlikul veebisaidil enne USA turule sisenemist.
FDA klassifitseerib haiglavoodid I klassi meditsiiniseadmeteks. USA Toidu- ja Ravimiamet määratleb I klassi seadmed kui „ei ole ette nähtud kasutamiseks elu või elu säilitamiseks või inimeste tervisekahjustuste ärahoidmiseks ning need ei pruugi kujutada endast potentsiaalset „Seadmed, mis kujutavad endast põhjendamatut haigestumise ohtu või vigastus." Need seadmed on kõige levinum FDA reguleeritud seadmete kategooria, mis moodustab 47% turul olevatest heakskiidetud seadmetest. I klassi seadmetel on minimaalne kokkupuude patsiendiga ja neil on minimaalne mõju patsiendi üldisele tervisele. Tavaliselt ei puutu I klassi seadmed kokku patsiendi siseorganite, kesknärvisüsteemi ega südame-veresoonkonna süsteemiga. Nendele seadmetele kehtivad minimaalsed regulatiivsed nõuded.
Meditsiiniseadmete FDA sertifikaat hõlmab: tootja registreerimist FDA-s, toote FDA registreerimist, tooteloendi registreerimist (510 vormi registreerimine), tooteloetelu (PMA ülevaade), märgistamist ja tehnilist ümberkujundamist, tollivormistust, registreerimist ning meditsiiniliste ja tervishoiuseadmed, Esitada tuleb järgmised materjalid:
(1) Viis koopiat täielikult pakendatud valmistoodetest
(2) Seadme struktuuriskeem ja tekstikirjeldus
(3) Seadme jõudlus ja tööpõhimõte
(4) Seadme ohutust tutvustavad või katsematerjalid
(5) Sissejuhatus tootmisprotsessi
(6) Kliiniliste uuringute kokkuvõte
(7) Toote juhised. Kui seadmel on radioaktiivsed omadused või eraldub radioaktiivseid aineid, tuleb seda üksikasjalikult kirjeldada.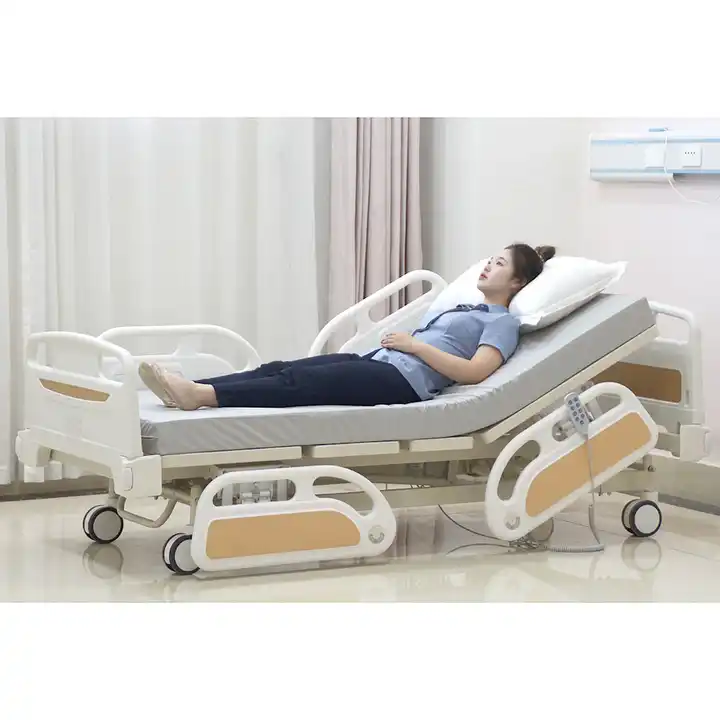
Projekti tsükkel
Aeg FDA hindamisest lõpliku heakskiitmiseni on üldiselt pikem ja seda kontrollib FDA; tavaliselt on kogu tavaline protsessitsükkel umbes 12 kuud
510K haiglavoodite taotlemise protsess on järgmine:
1. FDA 510(K) tehnilise dokumendi vastavusnõuded
2. USA FDA 510k registreerimisel kohaldatav standardanalüüs
3. Kinnitus olemasolevate dokumentide olemasolu kohta
4. Turul registreeritud toodete kogumine ja võrdlemine
5. Koostage tooteteave vastavalt USA FDA 510k nõuetele
6. Valmistage ette 510k registreerimisdokumenti vastavalt standarditele
7. Tehke parandused registreerimisdokumentide läbivaatamise tulemuste põhjal
8. Täitke ettevõtte registreerimine ja tooteloendi registreerimine
taishanincil on ülemaailmne ekspordisertifikaat
Sellel on 5 täielikult omavat tütarettevõtet
Hõlmab ehitusmaterjalide, kemikaalide ja meditsiiniseadmete tööstust
Oleme ülemaailmse ekspordisertifikaadiga tehas, mille aastane toodangu väärtus on 5 000 000 dollarit ja ekspordime enam kui 160 riiki üle maailma. Oleme kohaliku piirkonna suurim integreeritud tööstuspargi tehas. Vajadusel võtke meiega aegsasti ühendust ja saatke täpsem tooteinfo.
Postitusaeg: 21.11.2023




